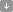알림마당
Separation of Bacteria
with an Overhead Stirrer
형광동소혼성화(FISH:fluorescence in situ dybridization) 분석 준비를 위한 아나목스 박테리아(anammox bacteria) 분리
서론
하수처리 공정의 생물학적 처리 단계에서는 미생물을 질산화(Nitrification)와 탈질화(Denitrification) 두 단계로 처리합니다. 탈질화(Denitrification)는 종종 혼합물을 처리하기 위해 유기 탄소를 필요하며, 이는 추가적인 비용이 될 수 있습니다. 이러한 두 단계의 처리 방법을 대신해 탈암모니아화(Deammonification) 과정으로 대체할 수 있습니다. 이 과정(탈암모니화 과정은) 암모니아 절반이 호기성 미생물에 의해 아질산염(Nitrite)으로 산화되기 때문에 한번의 과정으로 처리될 수 있습니다. 나머지 절반의 암모니아는 혐기성으로 기체 질소로 전환됩니다. 암모니아의 혐기성 전환은 아나목스(anammox)라는 미생물 때문에 가능합니다. 아나목스(anammox)의 느린 성장 속도로 인해 전체 과정에서 유기체의 농도를 모니터링 하는 것이 매우 중요합니다. 탈암모니화(Deammonification) 과정에서 사용되는 하수 슬러지(sludge)는 다양한 박테리아의 혼합물입니다.
목표: 형광동소혼성화(FISH: fluorescence in situ hybridization) 분석을 위한 Heidolph 오버헤드 스터러 RZR 2101 control을 이용한 아나목스 세포 응집체(agglomerates) 분리
The red power horse: 아나목스(Anammox) 박테리아
800~1100 나노미터 사이즈의 아나목스(anammox) 박테리아는 원형의 모양이며 우선적으로 세포군(cell aggregates)을 형성합니다. 시토크롬(cytochrome) C 단백질 복합체의 Fe3+ 중심 원자에 의해 유기체가 현저한 붉은 색을 띄게 됩니다. (그림 1)
(그림 1: Anammox bacteria agglomerate)
다른 원핵 생물과는 대조적으로 아나목스(anammox) 유기체는 아나목소섬(anammoxosome)이라는 막성 구조물을 가지고 있습니다. 이곳에서 아질산염과(nitrite)과 암모늄(ammonium)이 혐기적으로 기체 질소로 전환됩니다. 즉, 탈암모니화(Deammonification)가 발생합니다.
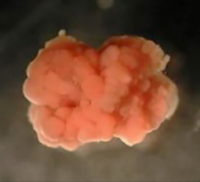
그림 2는 아나목소섬(anammoxoxome)을 크게 확대하여 나타낸 Candidatus kuenenia stuttgartiensis의 TEM 이미지를 보여 줍니다.
아나목스(anammox) 유기체는 기질의 추가에 매우 민감하게 반응하여 평균 15~80 µmol N₂ g/min을 생성합니다.
사용한 폐수 슬러지(sludge) 샘플 내 아나목스(anammox) 박테리아의 농도에 대한 정량적 분석을 하려면 세포 응집체(agglomerates)를 분리해야 합니다.
그림 2는 아나목소섬(anammoxoxome)을 크게 확대하여 나타낸 Candidatus kuenenia stuttgartiensis의 TEM 이미지를 보여 줍니다.
아나목스(anammox) 유기체는 기질의 추가에 매우 민감하게 반응하여 평균 15~80 µmol N₂ g/min을 생성합니다.
사용한 폐수 슬러지(sludge) 샘플 내 아나목스(anammox) 박테리아의 농도에 대한 정량적 분석을 하려면 세포 응집체(agglomerates)를 분리해야 합니다.
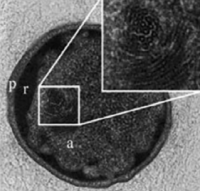
그림 2: TEM image of the anammox
bacterium Candidatus kuenenia
stuttgartiensis with an enlarged presentation
of the anammoxosome
혼성화(Hybridization)를 생분석 화학과 진화 생물학에서 가장 유용하게 만들 수 있는 것은 DNA 염기 사이의 특정 수소 결합을 사용하는 것 입니다. 고전적인 혼성화는 잘 알려진 핵산 혼합물에서 발생합니다. 여기서 각각의 DNA 가닥은 변성되고 labeled DNA probe와 혼합됩니다. 개별 염기의 특이적 결합으로 인해 DNA probe는 배양기간 동안 변성된 DNA 가닥에 연결됩니다.
일반적인 혼성화(Hybridization)과는 달리 형광동소혼성화(FISH: fluorescence in situ hybridization)는 세포에서 발생합니다. 특정 염기 페어링의 원리가 이 방법에서 사용됩니다. 이 방법은 박테리아의 혼합물에서 유기체를 식별할 수 있는 장점이 있습니다. 분석에 사용되는 대부분의 DNA probe는 15~30개의 뉴클레오티드(nucleotides)로 구성되어 있습니다. DNA probe는 양쪽 끝 또는 시퀀스의 3’ 또는 5’ 끝에서 형광색소(fluorochromes)로 표시 됩니다. 문제의 유기체는 형광 현미경(fluorescence microscopy)을 사용하여 결정될 수 있습니다. 원하는 결과를 얻기 위해 PTFE 유봉(pestle)을 오버 헤드 스터러에 삽입하여 샘플을 처리 하였습니다.
오버 헤드 교반기의 다른 사용 용도
오버 헤드 교반기는 많은 힘을 필요로 하는 많은 교반 작업으로 주로 알려져 있습니다. 점성이 높은 배지(media) 혼합, 균질화 또는 세포 배양 배지(culture media)에서 산소 및 다른 영양소를 잘 분배하기 위해 사용됩니다. 오버 헤드 교반기의 장점 중 하나는 교반기 본체에 다양한 임펠러 및 액세서리를 삽입할 수 있습니다. 맞는 툴과 함께 연결된 오버 헤드 교반기는 다양한 방법으로 사용될 수 있기 때문에 실험실에서 발견한 가장 유용한 장비 중 하나입니다.
이번 실험에서 Heidolph RZR 2102 control에 PTFE 유봉(pestle)을 결합하여 세포 응집체(agglomerates)를 분리 하였습니다. 유봉(pestle)과 결합된 Heidolph RZR 2102 control 사진을 그림 3에서 볼 수 있습니다.

그림 3: 유봉(pestle)과 결합된
Heidolph RZR 2102 control
(Heidolph, Schwabach, Germany)
실험 및 결과: 아나목스(anammox) 박테리아 형광동소혼성화(FISH: fluorescence in situ hybridization) 정량 분석을 위한 준비 및 결과
응집체(agglomerate)를 개별 세포로 분리하기 위해 조직 균질화기와 함께 PTFE 유봉(pestle)이 사용 됩니다. 유봉(pestle)을 교반기에 고정하고 분리할 박테리아를 PBS 용액과 함께 조직 균질화기에 넣습니다. 300 rpm 회전 속도에서 샘플은 15분 동안 위 아래의 움직임을 통해 처리됩니다. 테프론 유봉(pestle)과 조직 균질화기는 그림 4에서 볼 수 있습니다.

그림4: PTFE – Pestle with a tissue homogenizer
그 다음 샘플에 남아 있는 마지막 응집체(agglomerates)를 분리하기 위해 초음파 균질화기로 샘플을 처리합니다.
다음으로 샘플은 혼성화(hybridization) 방법(protocol)에 따라 추가적인 과정에 따라 처리됩니다.
응집체(agglomerates)와 개별 박테리아의 형광 착색 차이는 그림 5와 그림 6에서 확인할 수 있습니다.
그림 5는 PTFE 유봉(pestle)을 통한 분리 전의 슬러지(sludge) 샘플의 예를 보여줍니다. 붉은 색의 흐린 덩어리는 세포 응집체(agglomerates)가 존재하는 세포를 나타냅니다.
그림 6은 분리 과정을 거친 슬러지(sludge) 샘플은 나타냅니다. 세포가 분리되면 연구자는 이제 현미경을 사용하여 단일 세포의 수를 셀 수 있습니다.
다음으로 샘플은 혼성화(hybridization) 방법(protocol)에 따라 추가적인 과정에 따라 처리됩니다.
응집체(agglomerates)와 개별 박테리아의 형광 착색 차이는 그림 5와 그림 6에서 확인할 수 있습니다.
그림 5는 PTFE 유봉(pestle)을 통한 분리 전의 슬러지(sludge) 샘플의 예를 보여줍니다. 붉은 색의 흐린 덩어리는 세포 응집체(agglomerates)가 존재하는 세포를 나타냅니다.
그림 6은 분리 과정을 거친 슬러지(sludge) 샘플은 나타냅니다. 세포가 분리되면 연구자는 이제 현미경을 사용하여 단일 세포의 수를 셀 수 있습니다.
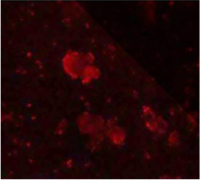
그림 5: Anammox bacteria
Before the separation: the red colour
indicates the fluorescent dye cy3
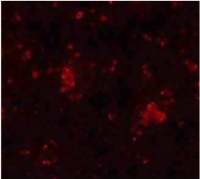
그림 6: Anammox bacteria
After the separation with the PTFE
pestle and tissue homogenizer:the red
colour indicates the fluorescent dye cy3
결론: 생물 분석 방법을 위한 준비 도구로 실험실 교반기를 사용할 수 있습니다.
오버 헤드 교반기 RZR 2102 Control을 통한 세포 분리가 성공적으로 완료 되었습니다. 그림 5와 6은 응집체 분리 전 후 눈에 띄는 차이를 나타냅니다. 분리 된 세포 배지(media)로 형광동소혼성화(FISH) 방법(protocol)을 이용한 박테리아를 정량화가 확실히 가능함을 보여줍니다. 전반적으로 올바를 액세서리가 장착 된 오버 헤드 스터러는 분석 프로세스 및 방법을 향상시키는 강력한 도구가 될 수 있습니다.
* 현재 RZR 2102 control 모델은 단종 되었습니다. 대신 Hei-TORQUE Precision 400 모델로 사용 가능합니다.
자료출처: Overhead Stirrer Whitepaper published December 2020 by Heidolph
https://heidolph-instruments.com/en/applications/Separation-of-anammox-bacteria~studyTopic28799
관련제품: Click here!!!